
Coinfecção por malária e COVID-19 em área não endêmica para malária no Brasil
Não foi possível determinar se a malária vivax grave em nosso paciente foi desencadeada pela coinfecção com COVID-19
10/05/2023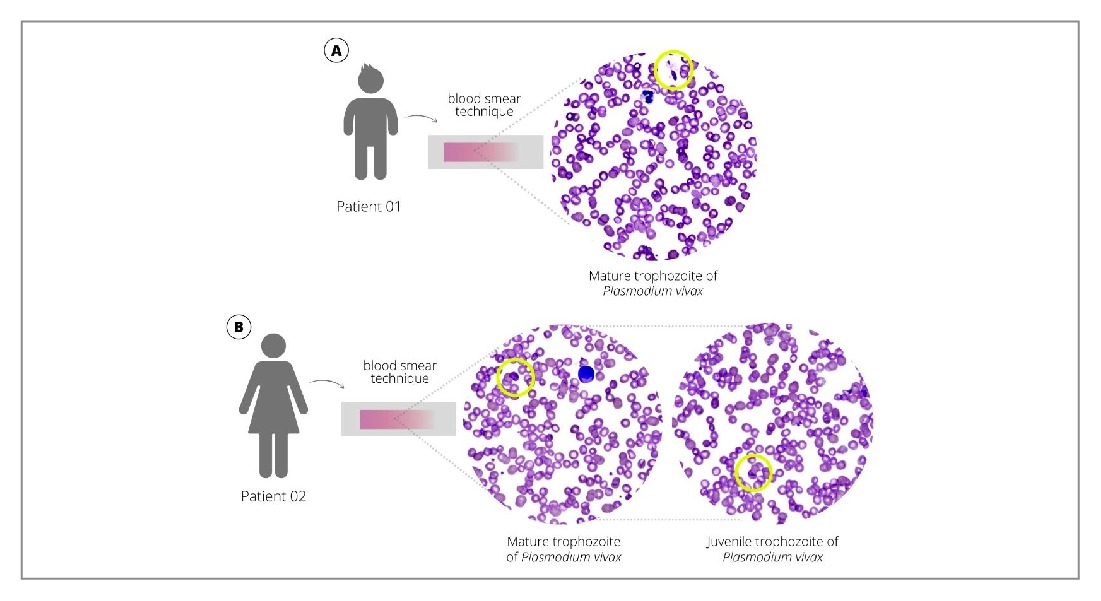
Trofozoítos de Plasmodium vivax em sangue periférico, usando esfregaço de sangue corado com Giemsa observado em um microscópio automatizado Easy Scan® Thermo Scientific
Rocha VF e cols. – Coinfecção por malária e COVID-19 no Brasil
Verônica de França Rocha [1] , Larissa Brasil [2],[3] , Erika de Oliveira Gomes [ 4 ] , [ 5 ] , Ricardo Khouri [6] , Gilcivaldo de Jesus Ferreira [1] , Beatriz Vasconcelos [6] , Marcela de Sá Gouveia [7] , Thais Souza Santos [7] , Mitermayer Galvão dos Reis [6],[8],[9] e Marcus Vinícius Guimarães de Lacerda [2],[3],[4]
[1]. Instituto Couto Maia, Salvador, BA, Brasil.
[2]. Instituto de Pesquisa Clínica Carlos Borborema, Fundação de Medicina Tropical Dr. Heitor Vieira Dourado, Manaus, AM, Brasil .
[3 ]. Instituto Leônidas & Maria Deane, Fiocruz, Manaus, AM, Brasil.
[4]. Universidade do Estado do Amazonas, Manaus, AM, Brasil.
[5]. Instituto Nacional de Pesquisas da Amazônia, Manaus, AM, Brasil.
[6]. Instituto Gonçalo Moniz, Fundação Oswaldo Cruz, Salvador, BA, Brasil.
[7]. Universidade Federal da Bahia, Hospital Universitário Professor Edgard Santos, Salvador, BA, Brasil.
[8]. Universidade Federal da Bahia, Faculdade de Medicina, Salvador, BA, Brasil.
[9]. Escola de Saúde Pública de Yale, Universidade de Yale, New Haven, Connecticut, Estados Unidos.
Autor correspondente: Verônica de França Diniz Rocha. e-mail: veronica.diniz.rocha@gmail.com
Contribuição dos autores
VFDR: Concepção e desenho do estudo, análise e interpretação dos dados, redação do artigo; LB: Análise e interpretação dos dados, aprovação final da versão a ser submetida; EOG: Aquisição de dados; RK: Análise e interpretação dos dados, redação do artigo; GJF: Aquisição de dados; BV: Aquisição de dados; Análise; MSG: Redação do artigo, aprovação final da versão a ser submetida; TSS: Aquisição de dados; MGR: Concepção e desenho do estudo; MVGL: Concepção e desenho do estudo, aprovação final da versão a ser submetida.
Conflito de interesses
Os autores declaram não haver conflitos de interesse.
Ajuda financeira
Nada a declarar.
Orcid
Verônica de França Rocha: https://orcid.org/0000-0003-3903-6580
Larissa Brasil: https://orcid.org/0009-0008-5263-7042
Erika de Oliveira Gomes: https://orcid.org/0009-0008-4572-9117
Ricardo Khouri: https://orcid.org/0000-0001-5664-4436
Gilcivaldo de Jesus Ferreira: https://orcid.org/0009-0007-8528-6819
Beatriz Vasconcelos: https://orcid.org/0000-0003-4029-9644
Marcela de Sá Gouveia: https://orcid.org/0000-0002-6915-0635
Thais Souza Santos: https://orcid.org/0009-0007-4162-0643
Mitermayer Galvão dos Reis: https://orcid.org/0000-0002-3051-9060
Marcus Vinícius Guimarães de Lacerda: https://orcid.org/0000-0003-3374-9985
Recebido em 23 de janeiro de 2023 – Aceito em 2 , 4 de março de 2023
Abstrato
O diagnóstico diferencial da doença do coronavírus 2019 (COVID-19) de outras doenças febris é um dos vários desafios impostos pela pandemia. Apresentamos um caso de malária grave e co-infecção por COVID-19 em uma região não endêmica para malária. Uma mulher de 44 anos com mal-estar, febre, hipotensão, icterícia e aumento do fígado e do baço foi internada na unidade de terapia intensiva. Os resultados da PCR quantitativa da transcrição reversa para o coronavírus 2 da síndrome respiratória aguda grave foram positivos. Testes rápidos, microscopia e PCR quantitativo foram positivos para Plasmodium vivax . Os perfis de tempestade de citocinas foram identificados. Não foi possível determinar se a malária vivax grave em nosso paciente foi desencadeada pela coinfecção com COVID-19.
Palavras-chave : malária. COVID 19. SARS-CoV-2.
Introdução
Em 2021, o Brasil registrou 139.211 casos de malária, predominantemente na Amazônia brasileira 1 . Algumas áreas, como regiões indígenas, rurais, assentamentos e garimpos, são freqüentemente associadas a um maior risco de transmissão da malária, sendo as áreas rurais responsáveis por 41,2% do total de casos autóctones na Amazônia brasileira. Aproximadamente 99,9% da transmissão da malária no Brasil ocorre na região amazônica, com 33 municípios respondendo por 80,0% do total de casos autóctones de malária em 2021. Na região extra-amazônica, 62,9% dos casos notificados ocorreram em pacientes que visitaram áreas endêmicas , considerados casos “importados” 1 .
A pandemia da doença de coronavírus 2019 (COVID-19) impôs vários desafios, incluindo o diagnóstico diferencial de outras doenças febris 2 . Durante a pandemia de COVID-19, as áreas rurais sofreram infecções mais tarde do que as áreas urbanas. Em regiões rurais, particularmente na parte norte do Brasil, com alta incidência de malária, uma alta carga de COVID-19 combinada com baixa capacidade de assistência à saúde pode ter aumentado a morbidade e mortalidade de ambas as doenças ou mesmo prejudicado o diagnóstico adequado em alguns locais 3 .
Uma breve pesquisa no Google Scholar, PubMed e Lilacs usando os termos “malaria” e “COVID-19” identificou vários relatos de casos, séries de casos, coortes e revisões sistemáticas; no entanto, nenhum abordou a produção de citocinas em casos de malária e co-infecção por COVID-19. O primeiro caso de coinfecção por malária e COVID-19 foi relatado em junho de 2020 no Catar, apresentando um paciente que havia viajado para o Paquistão três meses antes da internação. O paciente era um jovem do sexo masculino sem comorbidades, com malária grave por Plasmodium vivax , e foi sugerido que o caso era uma reativação de uma infecção anterior com parasitas em estágio latente do fígado ou hipnozoítas durante a infecção por COVID-19 4 . No Brasil, apenas um caso de coinfecção foi relatado em um homem saudável que viajou para uma área rural do estado de Mato Grosso 5 .
Aqui, apresentamos um caso de malária grave por P. vivax e coinfecção por COVID-19 em um assentamento rural no extremo sul da Bahia (Brasil), uma região não endêmica para malária. Além de descrever o caso clínico, ao contrário dos relatos anteriores, examinamos o perfil de citocinas das citocinas para entender a fisiopatologia subjacente a essa coinfecção.
Relato de caso
Em junho de 2021, um menino de 7 anos sem comorbidades, do sul da Bahia (nordeste do Brasil), residente em uma área periurbana, relatou febre, calafrios, fadiga, cefaleia, mialgia, dispneia, palidez, apatia e redução ingestão de alimentos. Outros membros da família relataram sintomas semelhantes. A paciente foi transferida para um hospital de referência em doenças infecciosas em Salvador/Bahia. A paciente apresentava palidez, taquicardia e taquipneia sem sinais de dificuldade respiratória. O exame físico revelou hepatomegalia e esplenomegalia indolor. Os exames laboratoriais identificaram hemoglobina 6,2 g/dL, hematócrito 17,4%, leucócitos 5.820/mm 3 e plaquetas 50.000/µL. O resultado do teste rápido IgM de coronavírus 2 da síndrome respiratória aguda grave ( SARS-CoV-2) foi positivo, embora o resultado do swab nasal SARS-CoV-2 PCR quantitativo reverso (RT-qPCR) tenha sido negativo.
Apesar de ser uma região não endêmica para malária, um recente surto de malária foi confirmado em um assentamento rural vizinho à região onde residiam o paciente e sua família. Um teste rápido para malária foi positivo para P. vivax, confirmado por microscopia e PCR quantitativo (qPCR) após extração de DNA genômico de lâminas ( Figura Complementar 1 ). O exame de esfregaço fino identificou 378,3 parasitas/µL de sangue, parasitemia de meia cruz. O paciente foi tratado inicialmente com três doses de artesunato endovenoso 2,4 mg/kg/dose a cada 12 h, depois duas doses de 2,4 mg/kg/dose diariamente, seguidas de cloroquina oral com primaquina, resultando em recuperação total
Durante a internação da criança, sua mãe, uma mulher de 44 anos, hipertensa leve, queixou-se de mal-estar e febre, sendo atendida no pronto-socorro do mesmo hospital. Na admissão, ela apresentava uma história de dez dias de febre, calafrios, cefaléia, mialgia, astenia e perda de peso. Ela foi diagnosticada com hipotensão (95 × 70 mmHg) na sala de emergência, que resolveu após reidratação intravenosa. Ela foi admitida na unidade de terapia intensiva adulto sem suporte de oxigênio ou drogas vasoativas. O exame físico revelou icterícia leve e aumento do fígado e do baço. Não foram observadas alterações nos sistemas respiratório ou cardíaco.
Exames laboratoriais na admissão revelaram hemoglobina 10,1 g/dL; hematócrito 27,5%; leucócitos 4.670/mm 3 (segmentado 79%); plaquetas 47.000/µL; RNI 1,0; proteína C-reativa 151.2; bilirrubina total 2,0 mg/dL (bilirrubina direta 1,2 mg/dL); gama-glutamil transferase 86 U/L; nitrogênio ureico no sangue (BUN) 53 mg/dL; creatinina 1,6 mg/dL; transaminase glutâmico-oxaloacética 38 U/L; aspartato aminotransferase 18 U/L; sódio 125 mEq/L, potássio 2,6 mEq/L; creatina fosfoquinase (CPK) 188 U/L; lactato desidrogenase 854 U/L. Os resultados SARS-CoV-2 RT-qPCR foram positivos com um swab nasal. A tomografia computadorizada de tórax revelou pequenas opacidades em vidro fosco com menos de 5% de envolvimento e derrame pleural laminar.
O P. vivax foi identificado por meio de um teste rápido de malária e confirmado por microscopia e qPCR após extração de DNA genômico de lâminas ( Figura complementar 1 ). O exame de esfregaço fino identificou 2.078,15 parasitas/µL de sangue, parasitemia de dois cruzamentos. ( Figura 1 ). Um perfil de tempestade de citocinas foi identificado ( Informações Suplementares 2 ) ( Figuras 2 e 3 ).
Os níveis plasmáticos de 29 citocinas foram medidos em pacientes infectados por P. vivax e SARS-CoV-2 (mãe), pacientes infectados por P. vivax (criança) e doadores saudáveis (controle). Níveis de expressão de interleucina (IL)-6 , IL-10, fator estimulante de colônias de granulócitos , IL-1RA, MIP-1a, interferon (IFN)-?, fator de necrose tumoral (TNF)-? , MIP-1b, IL- 8, IL-1b, IP-10, IL-1a, IL-7, IL-13 aumentaram ?10 vezes no paciente co-infectado (mãe) quando comparado com os níveis médios de citocinas do doador saudável e Plasmodium vivax -paciente infectado (criança) ( Figura 2 ); esses achados são compatíveis com a assinatura da tempestade de citocinas da patogênese da infecção respiratória grave, conforme revelado pela análise de enriquecimento biológico usando o software IPA ( https://digitalinsights.qiagen.com/IPA ( Figura 3 ).
Foi iniciado tratamento com artesunato endovenoso (2,4 mg/kg/dose às 0, 12 e 24 horas). Após administração de três doses parenterais e após parasitemia de ?1%, o tratamento foi alterado para hidroxicloroquina oral 600 mg/dia por três dias e primaquina 30 mg/dia por sete dias. O paciente posteriormente se recuperou completamente.
O Comitê de Ética e Pesquisa aprovou a publicação deste trabalho.
Discussão
Aqui, relatamos um caso de malária por P. vivax e coinfecção por COVID-19, uma forma grave de malária vivax em uma mulher de 44 anos com hipertensão leve sem evidências de manifestações graves de COVID-19. Apesar do diagnóstico de malária e da alta probabilidade de infecção por SARS-CoV-2 por contato com os pais, o COVID-19 não pôde ser estabelecido na criança, dada a possibilidade de resultado falso-positivo de SARS-CoV-2 por meio de teste sorológico rápido. O SARS-CoV-2 RT-PCR foi realizado dez dias após a observação dos primeiros sintomas na criança, o que pode explicar o possível resultado falso-negativo. Assim como a mãe, o pai da criança também teve um resultado SARS-CoV-2 RT-PCR positivo, aumentando a possibilidade de um resultado falso-negativo de SARS-CoV-2 RT-PCR na criança. Após a chegada de um indivíduo da Amazônia brasileira com malária não tratada, casos de malária foram documentados em um assentamento rural próximo a uma região urbana.
As doenças endêmicas , incluindo a malária, podem ser difíceis de distinguir da COVID-19, devido à semelhança dos sintomas, e a mesma dificuldade pode ocorrer em casos de coinfecção por malária e COVID-19, conforme descrito em relatos de casos anteriores 4,5 . Um estudo de coorte retrospectivo no Sudão inscreveu 321 pacientes confirmados com COVID-19 e 270 pacientes com malária co-infectados com COVID-19. Em comparação com a monoinfecção por SARS-CoV-2, a coinfecção com COVID-19 e malária foi associada ao aumento da mortalidade hospitalar por todas as causas 6 . A coinfecção com COVID-19 e malária grave foi relatada anteriormente, embora pouco explorada. Até onde sabemos, nosso estudo é o primeiro a descrever o perfil de citocinas em um paciente com infecção grave por malária que foi positivo para COVID-19 7,8 . Aqui, a tempestade de citocinas identificada no paciente co-infectado pode explicar a tendência de alta gravidade clínica em malária e pacientes co-infectados com COVID-19 descritos em estudos anteriores.
Durante a infecção por COVID-19, os monócitos e macrófagos aumentam, elevando os níveis de citocinas pró-inflamatórias, incluindo IL-6, IL-1, TNF-? e IL-8, que em alguns pacientes causa uma tempestade de citocinas, resultando em dificuldade respiratória aguda síndrome e falência de múltiplos órgãos 9 . Pacientes com infecções graves por SARS-CoV ou síndrome respiratória do Oriente Médio (MERS-CoV) exibem níveis séricos significativamente mais altos de IL-6, IFN-?, CCL5, CXCL8 e CXCL-10 do que pacientes com infecções mais leves 10 . Embora a mãe da paciente tivesse malária e co-infecção por COVID-19, ela não apresentava uma forma grave de COVID-19; ela experimentou uma tempestade de citocinas, que pode estar relacionada à ocorrência de malária grave.
Em indivíduos com infecção assintomática por P. vivax , os níveis de citocinas pró e anti-inflamatórias circulantes não aumentam, e uma tempestade de citocinas não é observada. A ativação excessiva de células imunes inatas e a resultante tempestade de citocinas são responsáveis pelos sinais e sintomas iniciais da malária e mediam formas graves da doença. Durante a fase aguda da infecção por P. vivax , altos níveis de citocinas pró-inflamatórias, incluindo IL-1?, IL-6, TNF?, IL-8 e IL-10 (uma citocina antiinflamatória), são consistentemente expressos em pacientes sintomáticos. A ativação excessiva de células imunes inatas pode levar a uma tempestade de citocinas com efeitos adversos no hospedeiro 11 .
Não foi possível estabelecer se a malária vivax grave observada em nosso paciente foi desencadeada pela coinfecção com COVID-19. Várias regiões com recursos limitados em todo o mundo enfrentaram desafios na realização de testes confirmatórios para COVID-19, com alguns considerados endêmicos da malária. Alguns sintomas da malária e da COVID-19 se sobrepõem, possibilitando que pacientes coinfectados recebam o diagnóstico de apenas uma das doenças, comprometendo o tratamento do paciente e o controle dessas doenças na comunidade 12 .
Agradecimentos
Agradecemos aos microscopistas de controle de qualidade Creuzimar Barros e Marinete Quadros, da Fundação de Medicina Tropical Dr. Heitor Vieira Dourado, pela leitura e revisão das lâminas, e à equipe do laboratório do Instituto de Pesquisa Clínica Carlos Borborema pela disposição em realizar o extração de DNA genômico e PCR para identificação de Plasmodium sp.
Referências
- Ministério da Saúde (MS). Secretaria de Vigilância em Saúde. Sistema Nacional de Vigilância em Saúde. Boletim Epidemiológico de Malária 2021. Número especial. Brasília: MS; 2021.
- Hussein MIH , Albashir AAD , Elawad OAMA , Homeida Malária e COVID-19: desvendando seus laços. Malar J. 2020;19(1):457 .
- Cuadros DF, Branscum AJ, Mukandavire Z, Miller FD, MacKinnon N. Dinâmica da epidemia de COVID-19 em áreas urbanas e rurais nos Estados Unidos. Ann Epidemiologia. 2021;59:16-20.
- Junaedi M, Katu S, Ilyas M, Daud N, Saleh S, Rasyid H, et al. Relato de Caso: Coinfecção Covid-19 e Malária Grave. EUR. J Mol. Clin. Med.2020; 7: 961-968.
- Braga T, Tomich L. Coinfecção COVID-19 e malária: um relato de caso. Soc. Bras. Med. Trop. 2022; 26: suplemento 1; 102279.
- Hussein R, e outros. Impacto da coinfecção por COVID-19 e malária nos desfechos clínicos: um estudo de coorte retrospectivo. Clin Microbiol Infect. 2022; ago;28(8):1152.e1-1152.e6.
- Hussein R, Guedes M, Ibraheim N, Ali M, El-Tahir A, Allam N, et al. Impacto da coinfecção por COVID-19 e malária nos desfechos clínicos: um estudo de coorte retrospectivo. Clin Microbiol Infect. 2022; 28:8:1152.e1-1152.e6.
- Sardar S, Sharma R, Alyamani TYM, Aboukamar M. COVID-19 e co-infecção por malária por Plasmodium vivax . IDCases . 2020;21:e00879 .
- Mehta P, McAuley DF, Brown M, Sanchez E, Tattersall RS, Manson JJ, et al. COVID-19: considere síndromes de tempestade de citocinas e imunossupressão. Lancet Digit Health. 2020;395:1033–34.
- Min CK, Cheon S, Ha NY, Sohn KM, Kim Y, Aigerim A, et al. Análise comparativa e cinética de excreção viral e respostas imunológicas em pacientes com MERS representando um amplo espectro de gravidade da doença. Representante Científico 2016; 6 :253-59.
- Antonelli LR, Junqueira C, Vinetz JM, Golenbock DT, Ferreira MU, Gazzinelli RT. A imunologia da malária por Plasmodium vivax. Immunol Rev. 2020 Jan;293(1):163-189. doi: 10.1111/imr.12816.
- Chanda-Kapata P, Kapata N, Zumla A. COVID-19 e malária: um desafio de triagem de sintomas para países endêmicos de malária. Int J Infect Dis. 2020;94:151–53.
FIGURA 1: Trofozoítos de Plasmodium vivax em sangue periférico, utilizando esfregaço de sangue corado com Giemsa observado em microscópio automatizado Easy Scan ® Thermo Scientific. A. Caso 1 – criança B. Caso 2 – mãe
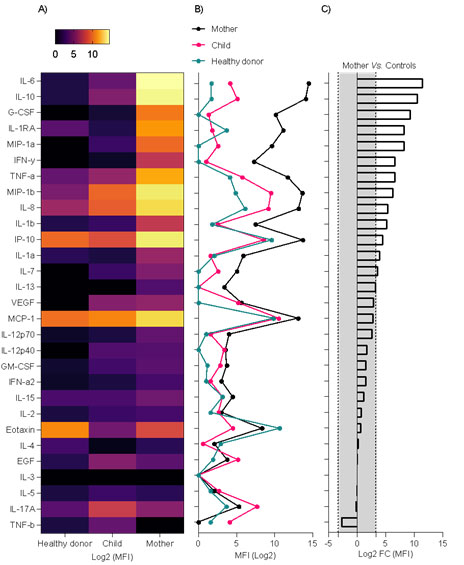
FIGURA 2: Assinatura de tempestade de citocinas na amostra de plasma de um paciente co-infectado por Plasmodium vivax e SARS-CoV-2 (mãe). (A) Mapa de calor mostrando log2 dos níveis de intensidade fluorescente mediana (MFI). (B) Gráfico de linha mostrando log2 dos níveis de MFI. (C) Gráfico de barras mostrando o log2 do cálculo da mudança de dobra dos níveis de MFI de paciente co-infectado por P. vivax e SARS-CoV-2 (mãe) versus média dos níveis de MFI do doador saudável e paciente infectado por P. vivax ( criança); a área cinza representa um valor absoluto de alteração <10 vezes. EGF, fator de crescimento epidérmico; G-CSF, fator estimulador de colônias de granulócitos; GM-CSF, fator estimulador de colônias de granulócitos-macrófagos; IL, interleucina; IFN, interferão; MCP-1, proteína quimioatraente de monócitos-1; TNF-a,-b, fator de necrose tumoral-?,-?; VEGF, fator de crescimento endotelial vascular
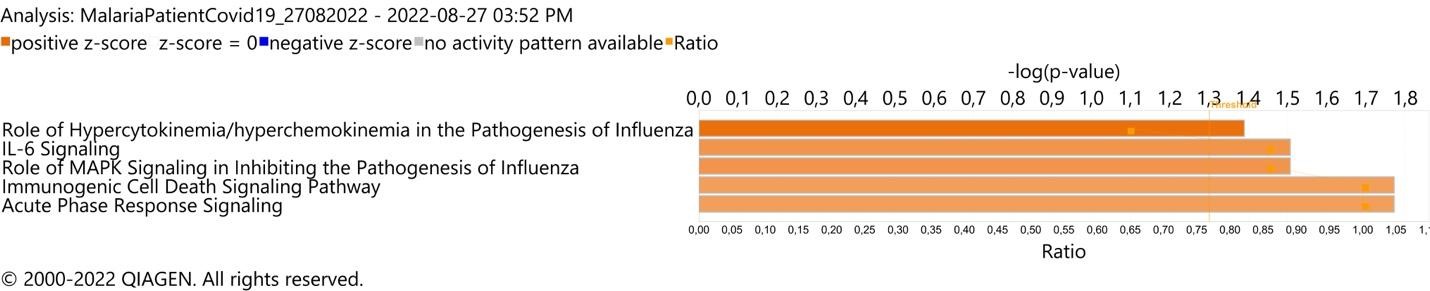
FIGURA 3: Análise de enriquecimento da via canônica da patogênese da infecção respiratória em amostra de plasma de paciente co-infectado por Plasmodium vivax e SARS-CoV-2 (mãe). (A) As 5 principais vias canônicas com valor p do teste exato de Fisher <0,05 e escore Z absoluto >2
Material suplementar
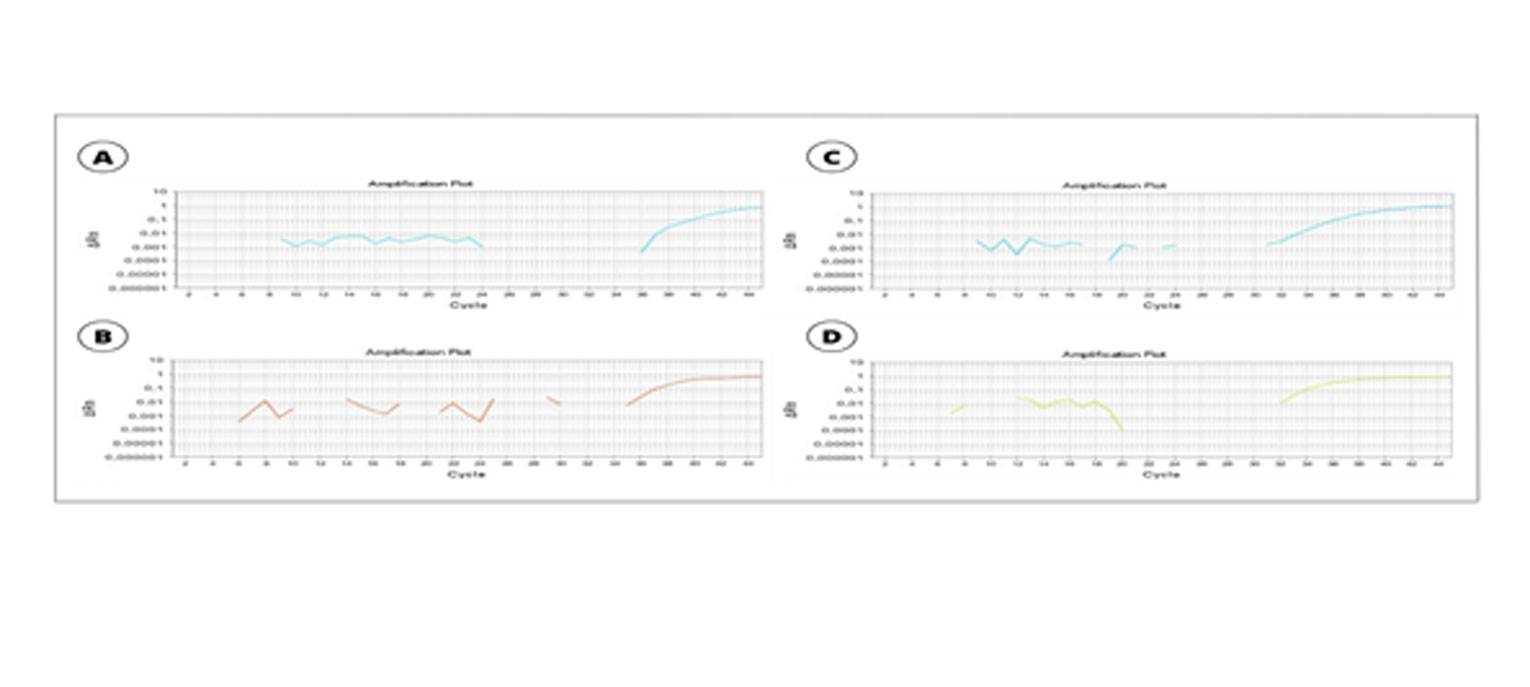
FIGURA COMPLEMENTAR 1: qPCR em tempo real do paciente 01 e do paciente 02. A. Amplificação usando um primer gene-específico de Plasmodium spp. do paciente 01. B. Amplificação usando primer espécie-específico de Plasmodium vivax do paciente 01. C. Amplificação usando primer gene-específico de Plasmodium spp. do paciente 02. D. Amplificação com primer espécie-específico de Plasmodium vivax do paciente 02
Informações complementares 2.
Materiais e métodos
Quantificação de marcadores solúveis no plasma
As concentrações dos seguintes marcadores solúveis (CCL2/MCP-1, CCL3/MIP-1?, CCL4/MIP-1?, CXCL8/IL-8, CXCL10/IP-10, EGF, Eotaxina, G-CSF, GM-CSF, IFN-?2, IFN-?, IL-10, IL-12P40, IL-12P70, IL-13, IL-15, L-17A, IL-1RA, IL-1?, IL-1?, IL-2, IL- 3, IL-4, IL-5, IL-6, IL-7, TNF-?, TNF-?, VEGF) no plasma ( mantido congelado a -80°C) foram medidos usando MILLIPLEX MAP Human Cytokine/Chemokine Magnetic Bead Panel 29-Plex (Merck Millipore, EUA), seguindo as instruções do fabricante.
Análise de enriquecimento da via canônica
O software IPA foi usado para análise de enriquecimento para identificar vias canônicas biológicas relevantes (QIAGEN Inc). Resumidamente, o cálculo do valor-p da análise de enriquecimento da via canônica foi baseado no conjunto de referência de 29 citocinas medidas, e uma mudança de corte > 10 vezes foi considerada estatisticamente significativa.
**Esta reportagem reflete exclusivamente a opinião do entrevistado.**








