Criptococose e fluconazol: estudo investiga resistência e seus impactos clínicos
Revisão analisa respostas do fungo e limites dos testes atuais
01/04/2025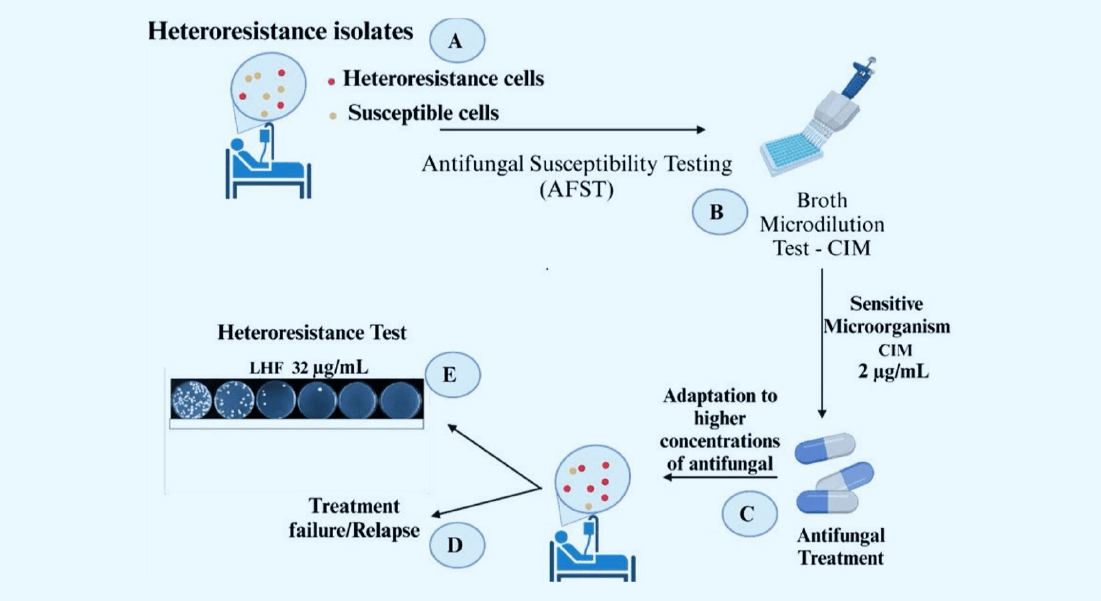
Em infecção por Cryptococcus spp., células podem resistir a doses elevadas de fluconazol. O teste padrão (MIC 2 µg/mL) não as identifica essas subpopulações, e a adaptação durante tratamento favorece recaídas. Novo teste aponta tolerância de até 32 µg/mL
A resistência ao fluconazol, antifúngico essencial no tratamento da criptococose, ganha contornos mais complexos com o fenômeno da heterorresistência em espécies de Cryptococcus. Um artigo publicado na Revista da Sociedade Brasileira de Medicina Tropical (volume 58, 2025), intitulado “Fluconazole Resistance and Heteroresistance in Cryptococcus spp.: Mechanisms and Implications” , conduzido por uma equipe de pesquisadores brasileiros e internacionais, detalha os mecanismos moleculares envolvidos, a evolução dos testes de suscetibilidade antifúngica e as implicações para pacientes acometidos por essa infecção fúngica grave. Realizado com apoio de instituições como o Instituto Nacional de Pesquisas da Amazônia (INPA) e a Fundação de Medicina Tropical Dr. Heitor Vieira Dourado, em Manaus, o estudo reflete a preocupação com um problema de saúde pública que persiste em regiões de alta vulnerabilidade, como a Amazônia.
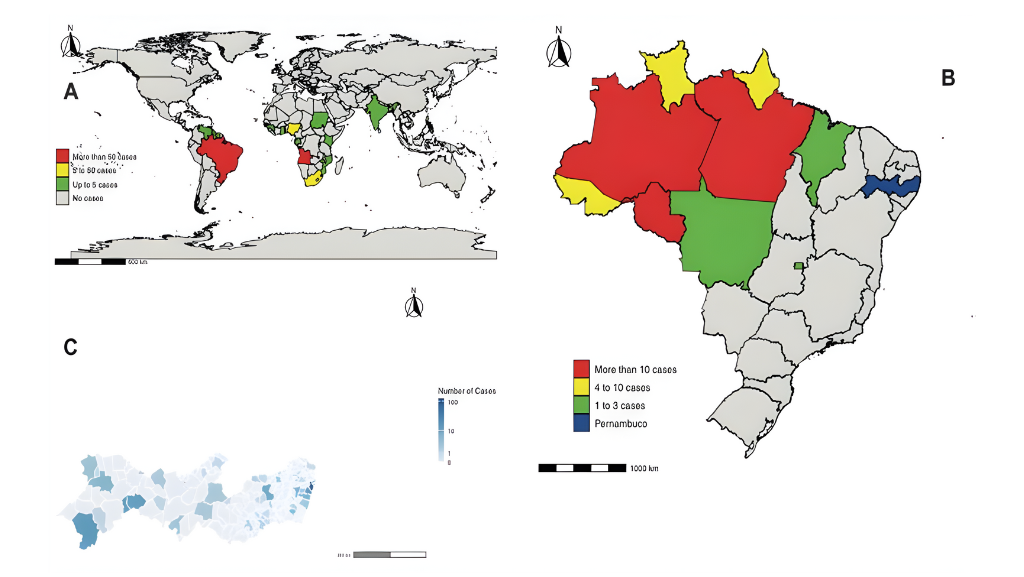
A criptococose, causada por Cryptococcus neoformans e Cryptococcus gattii, manifesta-se principalmente como meningite criptocócica em indivíduos imunocomprometidos, especialmente pessoas vivendo com HIV/Aids. Estimativas globais apontam aproximadamente 152 mil casos anuais dessa forma grave da doença, resultando em cerca de 112 mil óbitos – um reflexo de sua letalidade, que representa 19% das mortes relacionadas à Aids no mundo. Na América Latina, as taxas de mortalidade variam entre 30% e 60%, enquanto no Brasil, entre 2000 e 2012, registrou-se uma média de 619 mortes por milhão de habitantes, tendo a criptococose como causa principal em muitos casos. Na Amazônia brasileira, dados de autópsias realizadas entre 1996 e 2003 em pacientes com HIV/Aids indicam que a doença figurou como a sexta causa de morte em um hospital de referência, evidenciando sua relevância local.
O protocolo terapêutico para criptococose segue três fases distintas: indução, com anfotericina B lipossomal e flucitosina, para reduzir rapidamente a carga fúngica; consolidação, geralmente com fluconazol em doses de 400 a 800 mg/dia por pelo menos oito semanas; e manutenção, com 200 mg/dia do mesmo antifúngico por no mínimo 12 meses, visando prevenir recaídas. O fluconazol, por sua acessibilidade e administração oral, desempenha um papel central nas duas últimas etapas. No entanto, o aumento da tolerância de isolados de Cryptococcus a concentrações elevadas desse medicamento levanta questões sobre recaídas e falhas terapêuticas, fenômenos que intrigam pesquisadores e clínicos.
O estudo destaca dois conceitos centrais: a resistência tradicional e a heterorresistência. Na resistência, o fungo apresenta uma capacidade estável de crescer mesmo em presença de concentrações do antifúngico que normalmente inibiriam seu crescimento, medida pela concentração inibitória mínima (MIC). Já a heterorresistência caracteriza-se pela presença de uma subpopulação de células, derivada de uma linhagem inicialmente suscetível, capaz de sobreviver a doses muito superiores à MIC, adaptando-se a concentrações progressivamente maiores. Diferentemente da resistência convencional, esse fenômeno é transitório: ao remover o medicamento, as células heterorresistentes podem reverter ao estado suscetível original.
Os mecanismos moleculares por trás dessa adaptação envolvem alterações genéticas específicas. Os pesquisadores descrevem que a exposição ao fluconazol induz a duplicação do cromossomo 1 (Chr1) em Cryptococcus, onde estão localizados os genes ERG11 e AFR1. “Notamos que a duplicação do cromossomo 1 é uma resposta clara do fungo ao fluconazol, alterando genes cruciais para sua sobrevivência”, explica o Dr. João Vicente Braga de Souza, coordenador do estudo. O gene ERG11 codifica a enzima lanosterol 14α-desmetilase, necessária para a síntese do ergosterol, componente essencial da membrana fúngica que o fluconazol inibe. Já o gene AFR1 regula uma bomba de efluxo do tipo ABC, que expulsa o antifúngico da célula, reduzindo sua eficácia. Essa disomia cromossômica, observada tanto em experimentos in vitro quanto em modelos murinos tratados com fluconazol, surge como uma resposta adaptativa ao estresse químico, mas desaparece sem a pressão seletiva do medicamento – um indicativo de que a heterorresistência difere da resistência convencional.
A detecção desses fenômenos depende de métodos de avaliação da suscetibilidade antifúngica, cuja evolução o estudo revisa minuciosamente. Desde os anos 1980, o Clinical and Laboratory Standards Institute (CLSI) e, posteriormente, o European Committee on Antimicrobial Susceptibility Testing (EUCAST) estabeleceram padrões para testes como a microdiluição em caldo, descrita no documento M27-A4 do CLSI, que mede a MIC como a concentração capaz de reduzir o crescimento fúngico em 50%. Outras técnicas, como a difusão em disco e tiras de gradiente (teste de difusão em épsilon), complementam o arsenal diagnóstico. Sistemas automatizados, como Vitek 2™ e Sensititre Yeast One™, agilizam o processo, mas nenhum desses métodos detecta diretamente a heterorresistência.
Para identificar subpopulações heterorresistentes, os autores apontam o ensaio de perfil de análise populacional (PAP) como uma alternativa promissora. Nesse teste, uma suspensão fúngica é cultivada em placas com diferentes concentrações de fluconazol, permitindo a contagem de colônias que crescem acima da MIC inicial. O nível de heterorresistência ao fluconazol (LHF) é definido como a maior concentração que uma subpopulação tolera. Outro método, o ensaio de indução de resistência, submete isolados a doses crescentes do antifúngico, avaliando a adaptação máxima das células. Apesar de eficazes em laboratório, esses testes carecem de padronização e ainda não integram a rotina clínica, o que limita sua aplicabilidade.
Dados regionais reforçam a relevância do tema. Em isolados clínicos e ambientais do Amazonas, a equipe encontrou heterorresistência em várias amostras, com C. gattii responsável pela maior proporção de LHF elevado (≥16 µg/mL em 86% dos casos), em comparação com C. neoformans (46%). Estudos anteriores no Sudeste do Brasil e em outras regiões já haviam identificado essa tendência, associando altos níveis de heterorresistência a maior virulência em modelos animais. Em camundongos infectados com clones altamente heterorresistentes, a mortalidade atingiu 80% a 90%, contra 0% a 10% em clones com baixa heterorresistência, sugerindo um impacto biológico significativo.
No entanto, a tradução desses achados para a prática clínica enfrenta barreiras. Embora a heterorresistência esteja associada a falhas terapêuticas e recaídas – em um estudo com 143 pacientes com Aids, mais de 4% apresentaram recidiva com aumento de 8 a 12 vezes na MIC do fluconazol após meses de tratamento, a correlação com mortalidade humana permanece incerta. Fatores como carga fúngica no líquido cefalorraquidiano, contagem de linfócitos CD4+ e resposta inflamatória inicial mostram-se preditores mais consistentes de prognóstico ruim do que a heterorresistência isoladamente, conforme apontam pesquisas recentes.
A ausência de pontos de corte específicos para Cryptococcus nos padrões CLSI e EUCAST complica o cenário. Os valores usados para Candida spp. – MIC ≤ 8 µg/mL como suscetível, 16-32 µg/mL como dose-dependente e > 64 µg/mL como resistente – são frequentemente extrapolados, mas os autores alertam que os valores de corte epidemiológico (ECOFFs) para Cryptococcus variam por genótipo. Para C. neoformans VNI, o ECOFF é 8 µg/mL; para C. gattii VGII, chega a 32 µg/mL. Essa falta de especificidade dificulta a interpretação dos testes e a previsão de desfechos clínicos.
Os pesquisadores concluem que a heterorresistência ao fluconazol em Cryptococcus representa um desafio multifacetado. A adaptação transitória do fungo, mediada por alterações cromossômicas e bombas de efluxo, contrasta com a resistência estável e exige métodos diagnósticos mais sensíveis. “A heterorresistência cria um obstáculo significativo, e os testes atuais não conseguem captar essa adaptação em tempo real”, afirma o Dr. Braga de Souza. A revisão defende estudos longitudinais de maior escala para esclarecer a relação entre heterorresistência e desfechos clínicos, além do desenvolvimento de testes padronizados que possam guiar ajustes terapêuticos. Financiado pela Fundação de Amparo à Pesquisa do Estado do Amazonas (FAPEAM), o trabalho reflete a busca por soluções em um contexto em que a criptococose ainda ceifa vidas, especialmente entre populações com acesso limitado a cuidados de saúde.
Para médicos que atuam na Amazônia, onde a doença mantém alta incidência, o estudo oferece um alerta: os protocolos atuais podem não captar toda a dinâmica da resistência fúngica. Para pacientes que enfrentam recaídas sem explicação aparente, o tema sublinha a urgência de avanços que aliem ciência básica e prática clínica, reduzindo o peso de uma infecção que, mesmo com tratamento, deixa sequelas profundas.Confira o artigo “Fluconazole Resistance and Heteroresistance in Cryptococcus spp.: Mechanisms and Implications” publicado na Revista da Sociedade Brasileira de Medicina Tropical (RSBMT): https://doi.org/10.1590/0037-8682-0328-2024.
**Esta reportagem reflete exclusivamente a opinião do entrevistado.**