Quilotórax e ascite quilosa por paracoccidioidomicose juvenil: relato de caso
O quilotórax é uma das várias complicações da PCM e pode levar à insuficiência respiratória, mesmo em pacientes submetidos à terapia antifúngica
10/04/2023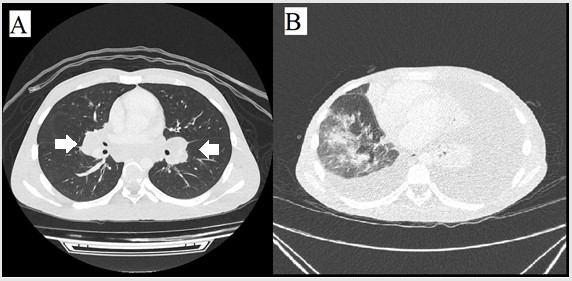
Tomografia contrastada do tórax (vista axial) mostrando: A- linfonodos aumentados bilateralmente (setas) e B- derrame pleural bilateral
Santos APFB et al. – Quilotórax e paracoccidioidomicose
Ana Paula Freitas Bahia dos Santos[1], Tomás Varella Costa Russo[1], Beatriz Pascuotte[1], Luis Felipe Silva Visconde[1], Adryelle Carolynne Nogueira Luetz[1], Andrey Biff Sarris[1], Matheus Dias Girão Rocha[1], Fernanda Guioti Puga[1], Gilberto Gambero Gaspar[1], Valdes Roberto Bollela[1] e Roberto Martinez[1]
[1]. Faculdade de Medicina de Ribeirão Preto, Hospital das Clínicas, Departamento de Clínica Médica, Infectologia, Ribeirão Preto, SP, Brasil.
Autor correspondente: Dra. Ana Paula Freitas Bahia dos Santos.
e-mail: anapaulafreitasb@gmail.com / apfbsantos@fmrp.usp.br
Contribuição dos autores
APFBS: Concepção e desenho do estudo; acompanhamento do paciente na enfermaria; coleta de dados do prontuário do paciente; análise e interpretação dos dados; elaboração do artigo; aprovação final da versão a ser submetida.
TVCR: Concepção e desenho do estudo; acompanhamento do paciente na enfermaria; análise e interpretação dos dados; elaboração do artigo; aprovação final da versão a ser submetida.
BP: Acompanhamento do paciente na enfermaria, coleta de dados do prontuário do paciente; elaboração do artigo; aprovação final da versão a ser submetida.
LFSV: Concepção e desenho do estudo; acompanhamento do paciente na enfermaria, coleta de dados do prontuário do paciente; elaboração do artigo; aprovação final da versão a ser submetida.
ABS: Aprovação final da versão a ser submetida.
ACNL: Aprovação final da versão a ser submetida.
MDGR: Concepção e desenho do estudo; acompanhamento do paciente na enfermaria; análise e interpretação dos dados; elaboração do artigo; aprovação final da versão a ser submetida.
FGP: Concepção e desenho do estudo; acompanhamento do paciente na enfermaria; revisão e aprovação final da versão a ser submetida.
GGG: Concepção e desenho do estudo; acompanhamento do paciente na enfermaria;revisão e aprovação final da versão a ser submetida.
VRB: Concepção e desenho do estudo; acompanhamento do paciente na enfermaria; revisão e aprovação final da versão a ser submetida.
RM: Concepção e desenho do estudo; acompanhamento do paciente na enfermaria; análise e interpretação dos dados; revisão e aprovação final da versão a ser submetida.
Conflito de Interesses
Nenhum.
Apoio Financeiro
Nenhum.
Orcid
Ana Paula Freitas Bahia dos Santos: https://orcid.org/0000-0001-6720-5367
Tomás Varella Costa Russo: https://orcid.org/0000-0003-0926-4582
Beatriz Pascuotte: https://orcid.org/0000-0001-9432-8274
Luis Felipe Silva Visconde: https://orcid.org/0000-0003-2392-6458
Adryelle Carolynne Nogueira Luetz: https://orcid.org/0000-0002-2832-888X
Andrey Biff Sarris: https://orcid.org/0000-0002-0708-3430
Matheus Dias Girão Rocha: https://orcid.org/0000-0003-2531-2126
Fernanda Guioti Puga: https://orcid.org/0000-0002-0380-5109
Gilberto Gambero Gaspar: https://orcid.org/0000-0002-6804-454X
Valdes Roberto Bollela: https://orcid.org/0000-0002-8221-4701
Roberto Martinez: https://orcid.org/0000-0001-6906-7981
Recebido em 21 de dezembro de 2022 – Aceito em 24 de março de 2023
Sinopse
Paracoccidioidomicose (PCM) é uma infecção fúngica sistêmica causada por espécies de Paracoccidioides. O quilotórax é uma complicação rara da PCM. Adolescente de 16 anos apresentou febre diária, linfadenomegalia, sudorese, perda de peso, dor ventilatório-dependente e disfagia, o que confirmou a PCM. Durante o tratamento, o paciente desenvolveu quilotórax e ascite quilosa. A linfadenopatia inflamatória e fibrótica crônica pode obstruir os vasos linfáticos, resultando no extravasamento da linfa para o abdômen ou cavidades pleurais. O quilotórax é uma das várias complicações da PCM e pode levar à insuficiência respiratória, mesmo em pacientes submetidos à terapia antifúngica.
Palavras-chave:
Paracoccidioidomycosis. Quilotórax. Ascite Quilosa
Introdução
A paracoccidioidomicose (PCM) é uma infecção fúngica sistêmica endêmica com incidência subnotificada no Brasil e na América Latina1,2. A incidência de PCM é de aproximadamente 1 a 3 casos por 100,000 habitantes anualmente em regiões endêmicas. O complexo de espécies Paracoccidioides brasiliensis e Paracoccidioides lutzii são agentes causadores que podem causar danos em quase todos os tecidos, com vários sinais e sintomas clínicos1. A PCM é classificada em duas apresentações clínicas, formas aguda/subaguda ou juvenil e crônica ou adulta, apesar da possibilidade de manifestações variadas1,3.
A forma crônica (PCM adulta) é a apresentação mais frequente, com prevalência de 74–96%. É altamente prevalente em adultos entre 30–60 anos. Ao contrário da forma juvenil, a PCM adulta tem uma razão de incidência de 22:1 entre homens e mulheres. Seu curso clínico é insidioso, com sintomas que variam entre 4–6 meses, ocasionalmente atingindo mais de um ano1.
A PCM aguda/subaguda ou juvenil é responsável por 5–25% dos casos de PCM. Com uma distribuição igualitária de gênero, é mais prevalente em crianças e adolescentes, embora possa afetar adultos jovens que raramente têm mais de 30 anos de idade. Além disso, a PCM juvenil tem um curso clínico curto (média de dois meses)1,3.
A forma aguda da doença se espalha rapidamente para vários órgãos e sistemas, principalmente o sistema fagocítico mononuclear. Linfadenomegalia generalizada e hepatoesplenomegalia são manifestações primárias bem conhecidas1,4. Complicações como ascite quilosa, doença hepática crônica e hipertensão portal são incomuns no PCM5 juvenil. Quilotórax, uma manifestação da PCM, é uma complicação rara. Até onde sabemos, apenas um desses casos foi documentado na literatura6.
O presente relato descreve um caso de quilotórax em paciente com PCM. Embora potencialmente fatal, isso é considerado raro. A PCM é uma doença endêmica prevalente na maior parte da América Latina2. É necessário destacar essa condição e incluí-la no diagnóstico diferencial do quilotórax.
Relatório de Caso
Paciente do sexo masculino de 16 anos, previamente saudável, nascido em Alfenas, Minas Gerais, mas residente na área urbana de São José do Rio Preto, São Paulo, Brasil, foi internado em um hospital universitário. Queixou-se de linfadenomegalia generalizada por três semanas. Ele tinha histórico de consumo de tabaco (5–6 cigarros/dia), uso de drogas ilícitas como maconha e cocaína e jardinagem.
Ele também relatou febre vespertina diária associada à fadiga, prostração, sudorese e perda de peso de 10 kg. Além disso, o paciente queixava-se de dor ventilatório-dependente no hemitórax direito e baixa disfagia com ingestão de alimentos sólidos. O exame físico revelou que o fígado era palpável, 4 cm abaixo da margem costal direita, com linfonodos palpáveis, de 1 a 3 cm em todas as cadeias superficiais, móveis e dolorosos.
Os exames de imagem realizados durante a internação hospitalar revelaram linfadenopatia mesentérica, retroperitoneal, pélvica, inguinal, mediastinal e hilar, hepatoesplenomegalia e ascite em grande volume (Figura 1). Os testes laboratoriais iniciais revelaram anemia normocítica e normocrômica; leucocitose; neutrofilia com desvio à esquerda; eosinofilia intensa; e níveis elevados de fosfatase alcalina, gama-glutamil transferase e proteína C-reativa no sangue. A ascite quilosa foi caracterizada pela comparação dos níveis de lipídios nesses fluidos com os níveis no soro (Tabela 1).
Uma biópsia de linfonodo inguinal revelou formação de granuloma com histiócitos epitelioides e células gigantes multinucleadas, numerosas estruturas fúngicas circulares e ovais consideravelmente variáveis em tamanho, e algumas com múltiplas exosporulações dentro e fora dos granulomas, sugerindo Paracoccidioides spp. (Figura 2)
Além disso, no teste de contraimunoeletroforese, foram detectados anticorpos anti-Paracoccidioides spp. e anticorpos séricos anti-Histoplasma capsulatum apresentaram títulos de 1:512 e 1:1, respectivamente. Nós iniciamos o tratamento com anfotericina B deoxicolato na dose de 1 mg/kg/dia, seguido de anfotericina B lipossomal (2 mg/kg/dia) após cinco dias. Após 12 dias, a anfotericina B foi substituída por itraconazol (400 mg/dia).
Durante a terapia com itraconazol, o paciente desenvolveu derrame pleural quiloso bilateral (Figura 1, Tabela 1) com ascite quilosa exacerbada. Consequentemente, o paciente frequentemente passa por paracentese e toracocentese terapêuticas.
No 33º dia de hospitalização, o paciente apresentou estado ventilatório deteriorado, necessitando de intubação orotraqueal, resultando em uma permanência de 14 dias na unidade de terapia intensiva (UTI). Durante este período, sulfametoxazol-trimetoprima intravenoso (800/160 mg) foi administrado a cada 8 horas. No entanto, após oito dias, o tratamento foi alterado para anfotericina B lipossomal (2 mg/kg/dia). Simultaneamente, octreotida (0.1 mg) foi administrado a cada 8 horas para tratar ascite quilosa, e o paciente também foi submetido à inserção de dreno pleural. A octreotida foi administrada durante 16 dias.
No 43º dia, após a extubação, o paciente desenvolveu uma pseudo-obstrução do cólon e foi tratado conservadoramente. No 57º dia, o paciente retornou à enfermaria de Doenças Infecciosas sob alimentação oral com baixo teor de gordura. Devido à piora da ascite quilosa, foi administrada terapia com corticosteroide oral com prednisona de 1 mg/kg/dia para reduzir o volume obstrutivo do nódulo linfático, embora nenhuma resposta tenha sido alcançada. No 59º dia, a terapia antimicrobiana foi substituída por sulfametoxazol-trimetoprim intravenoso (800/160 mg) a cada 8 horas. Subsequentemente, no 64º dia, a mesma dose de sulfametoxazol-trimetoprim foi administrada por via oral.
Dada a ausência de baixas taxas nos drenos torácicos, pleurodese química bilateral foi realizada no 66º dia. Após o procedimento, o paciente desenvolveu taquipneia e dor torácica, necessitando de oxigenoterapia suplementar. No 67º dia, foi realizada nova intubação orotraqueal. Posteriormente, foi realizada uma traqueostomia. O paciente recebeu medicamentos antibacterianos durante a admissão na UTI para tratar infecções relacionadas à assistência médica.
No 84º dia, o paciente apresentou parada cardiorrespiratória, que reverteu após 10 min. Posteriormente, o paciente apresentou melhora notável sem sequelas neurológicas e foi desmamado com sucesso da sedoanalgesia.
Embora o paciente tenha experimentado múltiplas infecções bacterianas secundárias durante a hospitalização, a recuperação foi satisfatória. Eventualmente, o tubo de traqueostomia foi removido e a alimentação por via oral foi reiniciada. Além disso, o derrame pleural não se repetiu após a pleurodese. Paracentese não era mais necessária, e a ascite foi resolvida inteiramente. Ao final da internação, a dose acumulada de anfotericina B foi de 6.500 mg.
Discussão
Os principais sintomas da PCM aguda/subaguda são linfadenomegalia localizada ou generalizada e hepatosplenomegalia. Outros sintomas incluem febre, perda de peso, anorexia, manifestações digestivas (dor abdominal, massas palpáveis, diarreia, icterícia, ascite e suboclusão intestinal) e lesões cutâneas/mucosas e osteoarticulares1,2,4.
Ao contrário da forma crônica, o envolvimento pulmonar é menos comum na PCM juvenil (70-100% em comparação com 10-20%, respectivamente)1,4. A radiografia torácica pode revelar aumento dos linfonodos hilares e paratraqueais, infiltração pulmonar e, raramente, derrame pleural|4,7. Segundo Mendes et al, linfadenomegalia e derrame pleural podem ser detectados em 50% e 2% das radiografias de tórax, respectivamente3. Os exames de imagem envolvendo o abdômen mostraram a presença de hepatosplenomegalia, massas ganglionares, dilatação dos ductos biliares (devido à compressão externa) e ascite4.
Um estudo prospectivo envolvendo 63 crianças com PCM identificou o aumento dos linfonodos como a manifestação clínica mais frequente, com fistulização dos linfonodos ocorrendo em 7 casos (10%). A linfadenomegalia é o principal achado nas radiografias de tórax, comumente no abdome8.
Alguns relatórios1,4 confirmaram que linfonodos intra-abdominais aumentados podem se fundir, levando a massas tumorais e, consequentemente, comprimindo vários órgãos. Esta informação levou especialistas a discutir os possíveis mecanismos envolvidos no desenvolvimento de ascite quilosa ou quilotórax. A linfadenomegalia é um achado comum na PCM e ocorre em outras condições (incluindo malignidade, sarcoidose, amiloidose e tuberculose). Pode comprimir os vasos linfáticos internos, resultando em extravasamento da quilha para a cavidade abdominal ou pleural6,9,10. Além disso, a necrose inflamatória dos linfonodos e a fibrose podem resultar no bloqueio da circulação linfática, dilatação dos vasos linfáticos e perda de linfa nos tecidos e cavidades corporais11.
Um diagnóstico de quilotórax e ascite quilosa pode ser alcançado com base na análise de fluidos. Os critérios diagnósticos para quilotorax incluem nível de triglicerídeos no líquido pleural > 110 mg/dL, nível de colesterol < 200 mg/dL, relação de triglicerídeos no líquido pleural e no soro > 1, e relação de colesterol no líquido pleural e no soro ?110. Alternativamente, o diagnóstico de ascite quilosa é baseado na aparência leitosa do líquido e em um nível de triglicerídeos >200 mg/dL. Neste relato de caso, o paciente apresentou um nível de triglicerídeos no fluido pleural de 132,94 mg/dL, nível de triglicerídeos no soro de 90,81 mg/dL, um nível de colesterol no fluido pleural de 54,10 mg/dL, nível de colesterol no soro de 125,95 mg/dL, uma relação triglicerídeos no fluido pleural / triglicerídeos no soro de 1,46 e uma relação colesterol no fluido pleural / colesterol no soro de 0,42. Os valores do paciente atenderam aos critérios para a presença de ascite quilosa e quilotorax.
Mesenterite linfadenopática também causa edema da mucosa intestinal e má absorção de proteínas e gorduras1,3,12. A perda de imunoglobulina e linfócitos frequentemente acompanham a perda de proteína nesses pacientes, o que pode levar a uma deficiência na imunidade mediada por células e humoral12. Considerando o caso presente, a perda de linfa, rica em proteínas e linfócitos, pode ter contribuído para a má resposta terapêutica aos antifúngicos orais e levado à imunossupressão, facilitando a ocorrência de infecções secundárias que requerem cuidados intensivos.
Em conclusão, este relatório descreve um caso de ascite quilosa e quilotórax, que são complicações raras e potencialmente fatais da forma aguda/subaguda ou juvenil. A inclusão da PCM no diagnóstico diferencial de quilotórax e ascite é necessária, especialmente em áreas endêmicas como a América do Sul.
Agradecimentos
Agradecemos ao Professor Dr. Fernando Chaud, do Departamento de Patologia do Hospital das Clínicas de Ribeirão Preto, pelas imagens fornecidas. Agradecemos também a assistência prestada pela equipe de Doenças Infecciosas e Unidade de Terapia Intensiva do Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo, Ribeirão Preto, Brasil.
Referências
- Shikanai-Yasuda MA, Mendes RP, Colombo AL, Queiroz-Telles F, Kono ASG, Paniago AMM, et al. Brazilian guidelines for the clinical management of paracoccidioidomycosis. Rev Soc Bras Med Trop. 2017 Sep-Oct;50(5):715-740. Erratum in: Rev Soc Bras Med Trop. 2017;50(6):879-80.
- Bellissimo-Rodrigues F, Bollela VR, Da Fonseca BA, Martinez R. Endemic paracoccidioidomycosis: relationship between clinical presentation and patients’ demographic features. Med Mycol. 2013;51(3):313-8.
- Mendes RP, Cavalcante RS, Venturini J. Paracoccidioidomicose. In: Salomão R. Infectologia Bases Clínicas e Tratamento. 1st ed. – Rio de Janeiro: Guanabara Koogan, 2017. P.352-446.
- Ferreira MS. Paracoccidioidomycosis. Paediatr Respir Ver. 2009;10(4):161-5
- De Macedo PM, Almeida-Paes R, Freitas DFS, Brito-Santos F, Figueiredo-Carvalho MHG, de Almeida Soares JC, et al. Hepatic Disease with Portal Hypertension and Acute Juvenile Paracoccidioidomycosis: A Report of Two Cases and Literature Review. Mycopathologia, 2017;182(9-10):915-919.
- Fernandes FF, Alves VO, Sánchez TE, Paula WD, Santana AN. Chylothorax in Paracoccidioidomycosis. Rev Inst Med Trop Sao Paulo. 2016; 58:57.
- Severo CB, Bello AGD, de Mattos Oliveira F, Guazzelli LS, Tregnago R, Haas M, et al. Pleural Effusion an Unusual Feature of Paracoccidioidomycosis: Report of Two New Cases with a Systematic Review of the Literature. Mycopathologia, 2013; 175(3-4):323-30.
- Pereira RM, Bucaretchi F, Barison Ede M, Hessel G, Tresoldi AT. Paracoccidioidomycosis in children: clinical presentation, follow-up and outcome. Rev Inst Med Trop Sao Paulo. 2004;46(3):127-31.
- Bhardwaj R, Vaziri H, Gautam A, Ballesteros E, Karimeddini D, Wu GY. Chylous Ascites: A Review of Pathogenesis, Diagnosis and Treatment. J Clin Transl Hepatol. 2018;6(1):105-13.
- Braun CM, Ryu JH. Chylothorax and Pseudochylothorax. Clin Chest Med. 2021;42(4):667-75.
- Martinez R. Digestive tract lesions. In: Franco M, Lacaz, CS, restrepo-moreno, A., Del Negro, G. Paracoccidioidomicosis. CRC Press, Boca Raton, USA, 1994, p. 289-302.
- Cavalcante RS, Souza BS, Duarte IX, Moraes MPT, Coelho KIR, Griva BL, et al. Herpes simplex Virus Pneumonitis in na Acute/Subacute Paracoccidiodomycosis Patient With Malabsorption Syndrome. Case-Report and Literature Review. Front.Fungal Biol. 2022; 2: 805502.

FIGURA 1: Quilotórax devido a paracoccidioidomicose juvenil
Legenda da figura: Tomografia contrastada do tórax (vista axial) mostrando um linfonodo bilateralmente aumentado – setas – (A) e um derrame pleural bilateral (B).
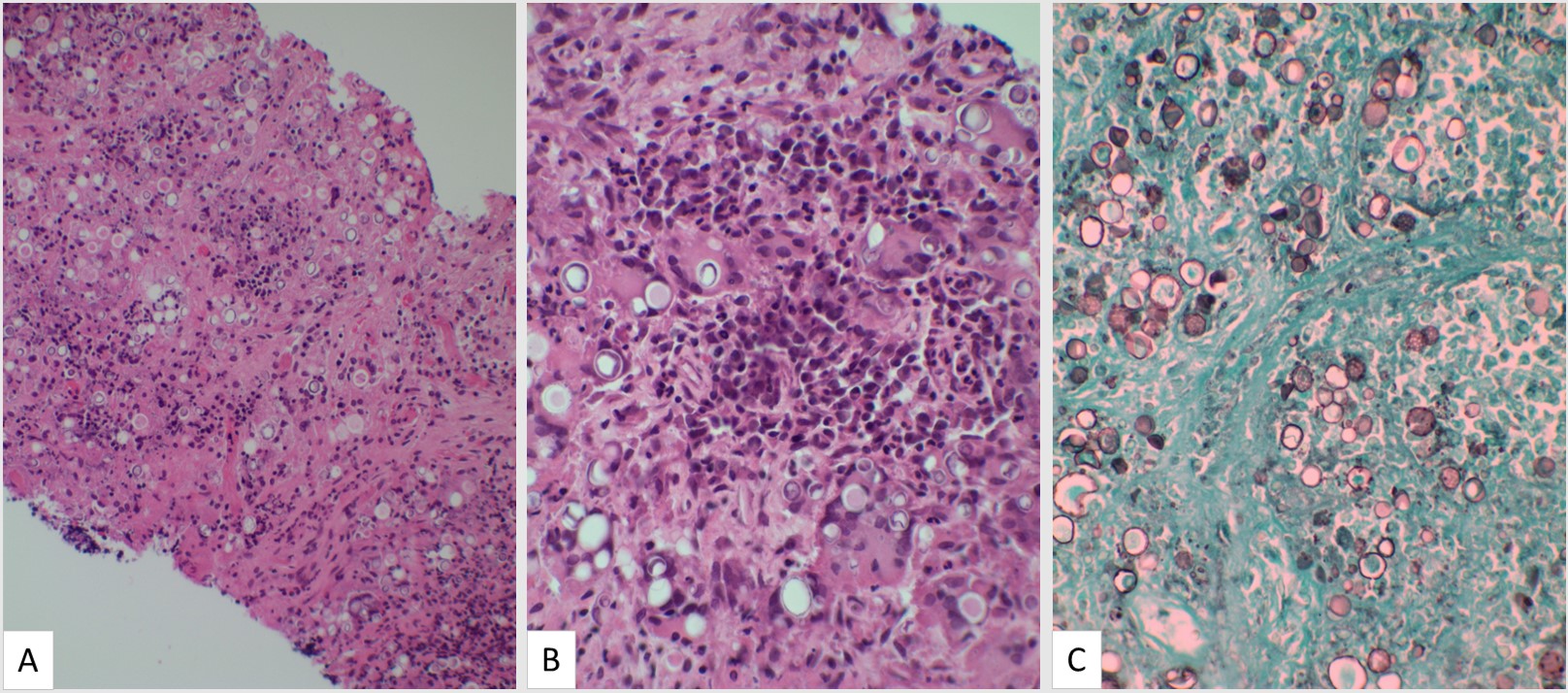
FIGURA 2: Biópsia de linfonodo inguinal com estruturas fúngicas sugestivas de Paracoccidioides brasiliensis
Legenda da figura: Biópsia de linfonodo inguinal com formação de granuloma e formas fúngicas redondas em seções coradas com hematoxilina-eosina (HE) 200× (A). HE 400× com granulomas soltos e estruturas fúngicas, com esporulação múltipla, sugerindo Paracoccidioides spp. (B) e mancha 400× Grocott-Gomori metenamina-prata (GMS) com formas fúngicas redondas com múltiplas exosporulações (C)
TABELA 1: Características citológicas e bioquímicas do líquido ascítico e pleural.
| Exame laboratorial | Líquido ascítico
|
Fluido pleural |
| Aparência | Leitoso/Hemorrágico | Serosanguíneo |
| Hemácias (cel.10 ³/ µl) | <10 | 38 |
| Leucócitos (/µl) | 290 | 4 363 |
| Linfócitos (%) | 86 | – |
| Células Polimorfonucleares (%) | 12 | 35.3 |
| Células mononucleares (%) | – | 63.4 |
| Colesterol (mg/dL) | – | 54.1 |
| Triglicerídeos (mg/dL) | 253.59 | 132.94 |
| Lactato desidrogenase (U/L) | 34 | 140.8 |
| pH | 7.466 | 7 |
| Proteínas totais (g/dL) | 2 | 2.79 |
| Glucose (mg/dL) | 126 | – |
**Esta reportagem reflete exclusivamente a opinião do entrevistado.**