Relato de caso: Cardioversor-desfibrilador implantável previne morte súbita em pacientes com cardiomiopatia chagásica na Amazônia brasileira
Existem poucos registros publicados da ocorrência de cardiomiopatia chagásica na Região Amazônica, na qual aneurismas ventriculares e taquiarritmias ventriculares foram descritos; ambos são manifestações clínicas com risco de morte
29/01/2021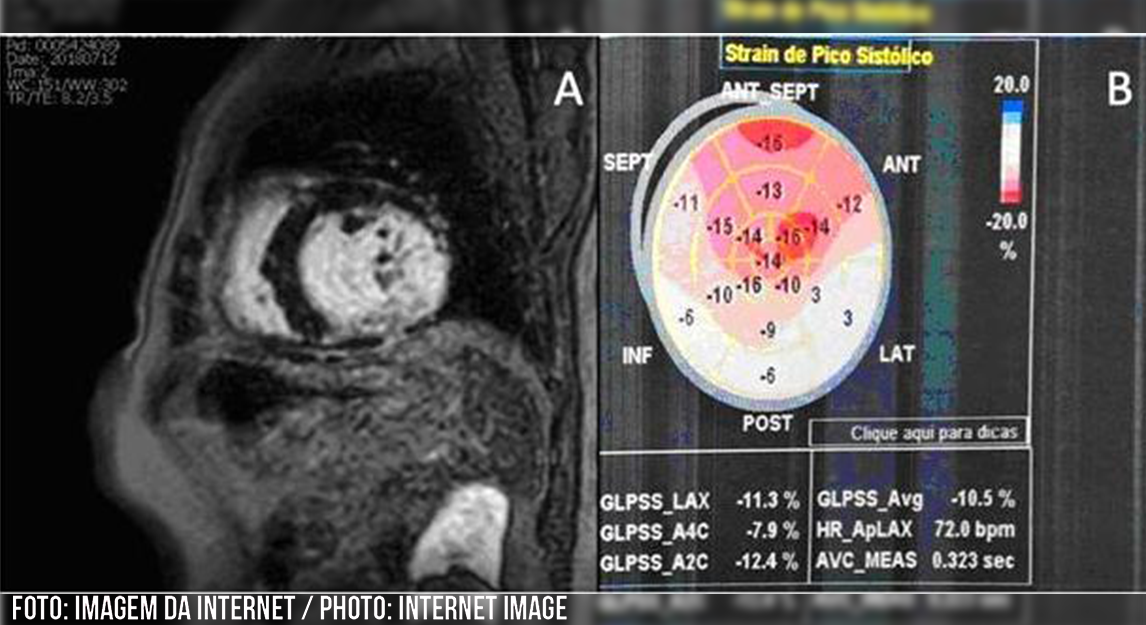
O artigo original foi submetido e aceito pela revista da Sociedade Brasileira de Medicina Tropical (Brazilian Journal of Tropical Medicine), onde será publicado integralmete
Muitos pacientes com cardiomiopatia chagásica crônica não conhecem o perigo da doença que tem e estão sob alto risco de morte súbita. Aqui, a Newsletter da SBMT mostra os benefícios de salvar vidas com um desfibrilador cardioversor implantável na reversão de taquicardia ventricular fatal. A descrição é crítica no cenário da Amazônia, onde a doença de Chagas crônica é incomum, apesar de ser transmitida por via oral, causando epidemias com alta mortalidade. O paciente foi acompanhado e tratado com sucesso por uma equipe de Manaus, Brasil, liderada pela cardiologista Dr. Kátia Couceiro.
O artigo original foi submetido e aceito pela revista da Sociedade Brasileira de Medicina Tropical (Brazilian Journal of Tropical Medicine), onde será publicado integralmete.
Autores:
Katia N Couceiro, Jéssica V Ortiz, Mônica RHS Silva, Débora RT Sousa, Kenny RSouza, Gabriela M Alencar, Laylah KC Magalhães, Maria das Graças VB Guerra, João MBB Ferreira e Jorge AO Guerra.
Instituições
Universidade Estadual da Amazônia, Fundação de Medicina Tropical “Dr. Heitor Vieira Dourado” e Fundação de Hematologia e Hemoterapia da Amazônia, Brasil.
Introdução à doença de Chagas na Amazônia
A doença de Chagas (CD) é endêmica na América Latina e se tornou um problema de saúde pública mundial devido ao aumento das migrações humanas. Foi considerada uma doença negligenciada em 2005. Cento e dez anos após sua descoberta, a Organização Mundial da Saúde estima agora que 70 milhões de pessoas correm o risco de contrair a doença, sete milhões de pessoas estão infectadas e a doença anualmente causa 10.000 mortes (1).
Esta doença pode se manifestar em dois estágios: uma forma aguda, sintomática ou assintomática, e uma fase crônica com apresentações indeterminadas, cardíacas ou digestivas. Aproximadamente 60% dos indivíduos infectados apresentam estado indeterminado, 25% a 35% desenvolvem cardiopatia e, destes, 10% podem desenvolver cardiopatia grave (2). Em regiões endêmicas, é uma importante causa de morte súbita. A cardiomiopatia chagásica (CCM) se manifesta com arritmias, distúrbios de condução, insuficiência cardíaca, acidentes tromboembólicos e morte prematura. Sua patogênese é multifatorial e complexa. A inflamação crônica pode resultar em fibrose e consequente disfunção do nó sinusal, anormalidades da condução atrioventricular e intraventricular e taquiarritmias ventriculares (2,3).
A Região Amazônica há muito é considerada uma área não endêmica para DC; entretanto, nas últimas décadas, com o aumento do número de casos agudos e crônicos, esse perfil mudou. No Estado do Amazonas, Brasil, o primeiro paciente com doença crônica foi registrado em 1973. Desde então, programas de vigilância e levantamentos sorológicos vêm sendo realizados, e novos casos foram detectados. Estudos anteriores sugerem menores níveis de morbidade relacionada à DC na Região Amazônica, provavelmente devido a diferentes linhagens T. cruzi das outras áreas endêmicas (3,4).
Apesar disso, alguns casos de CCM têm sido relatados na Amazônia. Os primeiros relatos de cardiomiopatia dilatada de etiologia chagásica nessa região datam de 2003, com dois casos fatais (5), três casos autóctones diagnosticados em 2009 (6), e casos de taquicardia ventricular em 2012(7).
Neste estudo, os autores apresentam um relato de caso de implantação bem-sucedida de cardioversor-desfibrilador para prevenção de morte súbita em paciente com CMC autóctone na Amazônia brasileira.
Relato do Caso
Homem, pintor, 60 anos, residente na capital do Estado, Manaus, mas nascido em Autazes, no interior do Amazonas, onde morou até os 18 anos, foi diagnosticado com doença de Chagas em 2015, após tentativa de doação sangue. Ele desenvolveu a forma cardíaca da doença e apresentou cardiomiopatia dilatada com disfunção ventricular. A fração de ejeção do ventrículo esquerdo (FEVE) era de 44% pelo método de Simpson. Um aneurisma apical foi observado, e um eletrocardiograma (ECG) basal de 12 derivações demonstrou um ritmo sinusal anormal e alterações na repolarização ventricular na parede lateral inferior. No registro de Holter de 24 horas, apresentava 16.881 arritmias ventriculares isoladas bigeminadas polimórficas.
Em 2018, uma ressonância magnética cardíaca foi realizada, revelando volumes cavitários aumentados e disfunção ventricular esquerda significativa, além de um realce transmural tardio na parede inferior-medial-basal (Figura 1A). Além disso, um ecocardiograma mostrou um strain longitudinal global de -10.5% e uma FEVE consideravelmente baixa de 29% (Figura 1B). Um ECG de alta resolução positivo para detecção de potenciais tardios foi realizado, e 12% de fibrose miocárdica foi identificada pelo escore de Selvester (8).
Em agosto de 2019, deu entrada no pronto-socorro com palpitações taquicárdicas, suores frios e síncope. A taquicardia ventricular monomórfica sem pulso foi monitorada e registrada no ECG (Figura 2A), que evoluiu para parada cardiorrespiratória em pronto-socorro. Foi imediatamente submetido a manobras de reanimação cardíaca e revertida para taquiarritmia após choque bifásico 200 J, visto que apresentava taquicardia ventricular isolada.
Desde o diagnóstico de DC e CMC, o paciente faz uso de medicamentos otimizados para insuficiência cardíaca: enalapril 20mg/dia, carvedilol 50mg/dia e espironolactona 25mg/dia. Durante o episódio de parada cardiorrespiratória com taquicardia ventricular monomórfica sem pulso e após sua reversão com desfibrilação, o paciente foi encaminhado para cardioversor-desfibrilador (CDI) implantável como profilaxia secundária para morte súbita.
Após a alta hospitalar, teve acompanhamento ambulatorial. Foi prescrito medicamento para insuficiência cardíaca associado a 400 mg/dia de amiodarona para evitar tempestades arrítmicas. Foi realizada nova monitorização com Holter de 24 horas, que demonstrou ausência de arritmias ventriculares. Aproximadamente três meses após o implante do CDI, a paciente apresentou episódio de choque do CDI, documentado por eletrograma intracavitário durante avaliação telemétrica (Figura 2B e 2C), automaticamente corrigido pelo cardioversor-desfibrilador implantável.
Discussão
Existem poucos registros publicados da ocorrência de cardiomiopatia chagásica na região amazônica, em que aneurismas ventriculares (6) e taquiarrititmias ventriculares (7) foram descritos; ambos são manifestações clínicas com risco de vida (9).
Marques et al. (2012)(7) relataram o primeiro caso autóctone conhecido de taquicardia ventricular em paciente na Amazônia. Este relatório agora destaca a importância do monitoramento contínuo de pacientes com DC na Região. O monitoramento permite a identificação de preditores de arritmias, e quanto menor a gravidade e o dano permanente, melhor o prognóstico. Consequentemente, menores serão os custos para o sistema público de saúde, e melhor será a qualidade de vida social e econômica do paciente (10).
Embora o diagnóstico e o monitoramento precoces sejam essenciais, o paciente deste relato já apresentava fibrose miocárdica identificada por ressonância magnética cardíaca, com realce tardio do miocárdio. Arritmias ventriculares malignas são mais prevalentes do que outras formas de doença cardíaca em pacientes com DC. Como a morte súbita cardíaca é comumente observada na DC, essa cardiomiopatia é uma indicação frequente para o implante de CDI 10.
A fibrose miocárdica é identificada por meio de ressonância magnética cardíaca. O realce tardio do miocárdio serve como um preditor significativo de arritmias e morte súbita em várias cardiomiopatias isquêmicas e não isquêmicas, como cardiomiopatia hipertrófica e DC. Deve ser considerado para monitoramento do paciente e avaliação da gravidade e intervenções (11).
A forma arritmogênica da DC é uma significativa causa de mortalidade (2). Embora pouco relatada na Região Amazônica, a forma arritmogênica da MCC é uma importante causa de morte súbita na região, conforme evidenciado em nosso caso.
Nas últimas décadas, a ocorrência de casos agudos e crônicos de DC aumentou significativamente em regiões onde os recursos diagnósticos e terapêuticos são escassos. Este relato de caso reforça a necessidade de melhorar os recursos diagnósticos regionais, identificar os pacientes de risco mais significativo e prevenir a morte súbita.
Referências
- World Health Organization (WHO). Fourth WHO Report on Neglected Tropical Diseases: Integrating Neglected Tropical Diseases into Global Health and Development. Geneva: WHO; 2017, 271 p.
- Marin-Neto JA, Cunha-Neto E, Maciel BC, Simões MV. Pathogenesis of chronic Chagas heart disease. Circulation. 2007;115(9):1109–23.
- Brum-Soares LM, Xavier SS, Sousa AS, Borges-Pereira J, Ferreira JMBB, Costa IR, et al. Morbidade da doença de Chagas em pacientes autóctones da microrregião do Rio Negro, Estado do Amazonas. Rev Soc Bras Med Trop. 2010;43(2):170–7.
- Coura JR, Junqueira AC, Ferreira JMB. Surveillance of seroepidemiology and morbidity of Chagas disease in the Negro River, Brazilian Amazon. Mem Inst Oswaldo Cruz. 2018;113(1):17–23.
- Albajar PV, Laredo SV, Terrazas MB, Coura JR. Miocardiopatia dilatada em pacientes com infecção chagásica crônica. Relato de dois casos fatais autóctones do Rio Negro, Estado do Amazonas. Rev Soc Bras Med Trop. 2003;36(3):401–7.
- Ferreira JMBB, Guerra JAO, Barbosa MGV. Ventricular aneurysm is a chronic chagasic patient from the Brazilian Amazon. Rev Soc Bras Med Trop. 2009;42(4):474-5.
- Marques AEAS, Ferreira JMB, Maldonado JGA, Santos FGC, Costa DA, Resende GAS, et al. Morte súbita abortada em paciente chagásico crônico na Amazônia Brasileira: relato de caso. Rev Hosp Univ Getúlio Vargas. 2012;11(1):44–8.
- Loring Z, Chelliah S, Selvester RH, Wagner G, Strauss DG. A detailed guide for quantification of myocardial scar with the Selvester QRS score in the presence of electrocardiogram confounders. J Electrocardiol. 2011;44(5):544–54.
- Sarabanda AVL, Marin-Neto JA. Predictors of mortality in patients with Chagas cardiomyopathy and ventricular tachycardia not treated with implantable cardioverter-defibrillators. PACE – Pacing Clin Electrophysiol. 2011;34(1):54–62.
- Barbosa MPT, Da Costa Rocha MO, De Oliveira AB, Lombardi F, Ribeiro ALP. Efficacy and safety of implantable cardioverter-defibrillators in patients with Chagas disease. Europace. 2013;15(7):957–62.
- Senra T, Ianni BM, Costa ACP, Mady C, Martinelli-Filho M, Kalil-Filho R, et al. Long-Term Prognostic Value of Myocardial Fibrosis in Patients With Chagas Cardiomyopathy. J Am Coll Cardiol. 2018;72(21):2577–87.
FIGURA 1: A) Ressonância magnética cardíaca com presença de realce transmural tardio na parede médio-basal inferior; B) Ecocardiograma transtorácico com deformação longitudinal global (-10.5%)
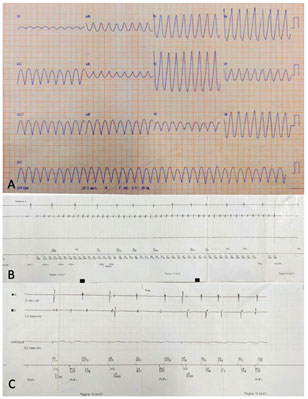
FIGURA 2: A) ECG basal com taquicardia ventricular monomórfica sem pulso; B) Taquicardia ventricular sustentada detectada pelo eletrograma intracavitário; C) Eletrograma intracavitário estimulando os átrios e ventrículos após choque de CDI
**Esta reportagem reflete exclusivamente a opinião do entrevistado.**