Relato de caso: Dengue como causa potencial de colestase intra-hepática falciforme: relato de dois casos
Este estudo descreve a primeira associação entre colestase intra-hepática por doença falciforme e dengue
06/07/2021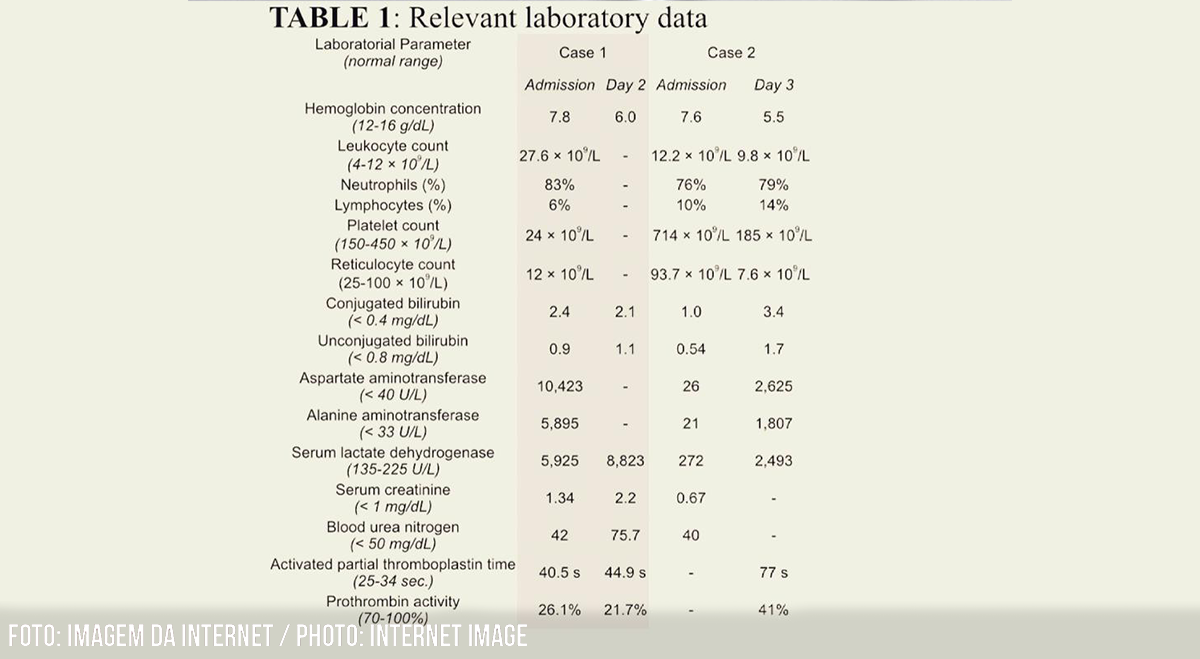
Foram descritos dois casos de colestase intra-hepática por doença falciforme associada à dengue. Dano com disfunção endotelial é um mecanismo envolvido em complicações hepatobiliares graves relacionadas às doenças falciformes
Oliveira LR et al. – Dengue como causa potencial de colestase intra-hepática de células falciformes
Leonardo Rodrigues de Oliveira [1], Ana Laura Castro Costa [1], Paula Veloso Almeida [1], Luzia Beatriz Ribeiro Zago [1], Vanessa Afonso da Silva [1] e Sheila Soares-Silva [1]
[1]. Universidade Federal do Triângulo Mineiro, Serviço de Hematologia e Hemoterapia, Uberaba, MG, Brasil.
Autor correspondente: Leonardo Rodrigues de Oliveira.
e-mail: leonardorodoli@hotmail.com
ORCID: https://orcid.org/0000-0003-1882-1694
Recebido em 20 de março de 2021
Aceito em 15 de junho de 2021
Resumo
A colestase intra-hepática da doença falciforme é uma síndrome potencialmente fatal caracterizada por icterícia, hepatomegalia dolorosa e disfunção orgânica. Foram descritos dois casos de colestase intra-hepática falciforme associada à dengue. Dano/disfunção endotelial é um mecanismo envolvido em complicações hepatobiliares graves relacionadas à doença falciforme. No entanto, permanecem desconhecidos os motivos do não aumento da admissão de pacientes com doença falciforme com complicações hepatobiliares agudas graves desencadeadas por dano/disfunção endotelial devido à dengue. Este estudo descreve a primeira associação entre colestase intra-hepática falciforme e dengue.
Palavras-chave: Dengue. Doença falciforme. Células Endoteliais.
Introdução
As complicações hepatobiliares associadas à doença falciforme (DF) incluem manifestações agudas e crônicas de fisiopatologia e gravidade distintas. Dentre as complicações hepatobiliares agudas, a colestase falciforme intra-hepática (SCIC) é uma síndrome potencialmente fatal caracterizada por icterícia, hepatomegalia dolorosa e disfunção orgânica (1-3). Condições predisponentes para uma crise vaso-oclusiva, como desidratação, infecção e trauma, podem ser causas potenciais de SCIC.
Foram relatados dois casos de SCIC associados à dengue. Este é o primeiro relatório que descreve esta associação, após realizar uma busca exaustiva nas bases de dados PubMed e Google Scholar por artigos em inglês publicados de 2001 a 2020 usando os termos “Sickle cell anemia”, “Sickle cell disease”, “Cholestasis”, “Intrahepatic cholestasis” and “Dengue”.
Relato de caso
Caso 1:
Uma paciente de 16 anos foi internada durante o verão com história de quatro dias de mialgia difusa, cefaleia retro-orbital, dor abdominal, febre e calafrios. Na admissão, a paciente apresentava-se pálida e ictérica, com taquicardia (123/min), fígado palpável 1 cm abaixo da borda costal direita e baço não palpável. A pressão arterial da paciente estava normal. A saturação arterial de oxigênio em ar ambiente era de 99%. A paciente tinha S? +-talassemia (genótipo S/tal ?), e os dados laboratoriais médios do acompanhamento ambulatorial foram a concentração de hemoglobina sérica (Hb) 11,7 g/dL, volume corpuscular médio 62 fL, contagem de leucócitos de 6.7 × 109/L e contagem de plaquetas de 123 × 109/L. A paciente não fez uso de hidroxiureia.
Os resultados dos testes laboratoriais iniciais são apresentados na tabela 1. Foi detectada acidose metabólica (pH 7,29; pCO2 28 mmHg; HCO3 13,8 mmol/L). A sorologia para hepatites virais (A, B e C) foi não reativa. A ultrassonografia abdominal revelou hepatoesplenomegalia, ascite moderada e derrame pleural bilateral sem detecção de cálculos biliares ou dilatação dos ductos biliares intra-hepático e extra-hepático. Com base nos dados epidemiológicos, clínicos e laboratoriais locais de um paciente com anemia falciforme e com a confirmação sorológica de dengue (reagente IgM – grupo de risco D, segundo os critérios do Ministério da Saúde do Brasil) (4), o diagnóstico de SCIC associado a dengue (dengue febre hemorrágica) foi considerado. A paciente foi tratada com hidratação vigorosa, analgesia, transfusão de concentrado de hemácias para atingir a concentração alvo de hemoglobina S (HbS) <30% (exsanguineotransfusão) e antibioticoterapia intravenosa (ceftriaxona 2 g/dia).
Doze horas após a admissão, o quadro clínico agravou-se com surgimento de dificuldade respiratória, sonolência e intensificação da dor abdominal com rápido aumento da hepatoesplenomegalia (baço e fígado palpáveis ao nível das cristas ilíacas). Os parâmetros laboratoriais deterioraram-se com a intensificação da anemia, LDH elevado e disfunção renal e hepática (Tabela 1). O tratamento adicional incluiu a manutenção da transfusão de concentrado de hemácias (alcançou HbS 19,8%) e medidas de suporte, como hemodiálise e ventilação mecânica na unidade de terapia intensiva. Houve agravamento da insuficiência orgânica, e a paciente morreu oito dias depois.
Caso 2:
Uma mulher de 24 anos foi internada com histórico de um dia de mialgia difusa, artralgia, cefaleia retro-orbitária, vômitos e febre. A paciente estava pálida, ictérica e taquicárdica (108/min). A pressão arterial da paciente estava normal. O fígado e baço não eram palpáveis. A saturação arterial de oxigênio em ar ambiente era normal (98%). A paciente apresentava anemia falciforme (genótipo SS) com acompanhamento ambulatorial irregular e sem história de ingestão de hidroxiureia. Os dados laboratoriais médios do acompanhamento ambulatorial mostraram: Hb 8 g/dL, contagem de leucócitos de 20.5 × 109/L e contagem de plaquetas de 612 × 109/L.
Na admissão, os exames laboratoriais revelaram os achados descritos na tabela 1. A suspeita de dengue clássica foi confirmada pela detecção do teste do antígeno da proteína não estrutural 1 (NS1) (grupo de risco C), e o diagnóstico de crise falciforme associada à dengue foi considerado. O tratamento inicial consistiu em hidratação vigorosa, analgesia e ceftriaxona intravenosa (2 g/dia).
Dois dias após a admissão, houve piora clínica caracterizada por sonolência, hepatomegalia dolorosa (fígado palpável a 6 cm abaixo do rebordo costal direito) e insuficiência respiratória. Os exames laboratoriais de acompanhamento detectaram queda na hemoglobina sérica, reticulocitopenia, queda acentuada na contagem de plaquetas, aumento na LDH e disfunção renal aguda (Tabela 1). Os testes de função renal foram normais. A sorologia para hepatite viral (A, B e C) foi negativa. A ultrassonografia abdominal revelou hepatomegalia, ectasia da veia supra-hepática, cálculo único (1,8 cm) na vesícula biliar sem sinais inflamatórios e sem dilatação das vias biliares intra-hepática e extra-hepática. Devido à acentuada deterioração clínica e laboratorial, considerou-se provável diagnóstico de SCIC e instituiu-se suporte com concentrado de hemácias (exsanguineotransfusão até a HbS atingir 28%) e ventilação não invasiva. Posteriormente, houve melhora clínica progressiva, com recuperação completa do paciente.
Discussão
A SCIC é uma complicação aguda e grave com alta mortalidade em pacientes com doença falciforme, principalmente em pacientes com anemia falciforme e talassemia S? (5-8); no entanto, a fisiopatologia permanece obscura (5,7). O possível mecanismo envolve uma sequência de eventos que culminam em disfunção hepática e inclui adesão de eritrócitos deformados ao endotélio vascular, obstrução e congestão dos sinusóides hepáticos, hipoxemia, balonismo, isquemia e morte de hepatócitos (1-3,5-7).
O diagnóstico de SCIC deve ser considerado em pacientes com DF e colestase não obstrutiva, geralmente acompanhada por elevação acentuada das transaminases e hepatomegalia dolorosa. A SCIC está associada à disfunção orgânica aguda, especialmente, mas não exclusivamente restrita às disfunções renais e hepáticas (6,9). Concentrações séricas de transaminases acima de 1,000 U/L são comumente observadas (1). Diagnósticos diferenciais como colelitíase obstrutiva, coledocolitíase obstrutiva, hepatite viral e hepatite autoimune devem ser excluídos (2,6,7). Em casos graves, pode surgir deterioração funcional aguda e de múltiplos órgãos associada a coagulopatia, estado mental alterado e insuficiência renal e hepática aguda (2,5,7).
O tratamento não foi definido com precisão por estudos prospectivos (2,6). As intervenções terapêuticas para SCIC incluem hidratação, analgesia, suplementação de oxigênio, antibioticoterapia (quando indicada) e transfusão de hemocomponentes (concentrado de hemácias, plasma fresco congelado). A exsanguineo-transfusão para reduzir a proporção de HbS diminui o processo de falcização e é a intervenção terapêutica predominante, apesar da ausência de estudos que definam valores ótimos para HbS (6-8). A transfusão de plasma fresco congelado pode ser usada para corrigir a coagulopatia (3).
Dados do Ministério da Saúde do Brasil publicados em 2018 revelam que existem entre 60.000–100.000 pacientes com DF no Brasil (10). O boletim epidemiológico publicado em abril de 2019 pelo Ministério da Saúde do Brasil informava que entre 30 de dezembro de 2018 e 23 de março de 2019, ocorreram 273.193 casos possíveis de dengue no Brasil (incidência estimada de 131 casos/100.000 habitantes), com 210 casos graves confirmados e 80 mortes (11). No mesmo boletim, o Estado de Minas Gerais contabilizou 67.363 novos casos de dengue com incidência estimada de 320,2 casos/100,000 habitantes (11).
No que diz respeito à fisiopatologia da DF, a polimerização da HbS, a vaso-oclusão e a anemia hemolítica são os principais fatores responsáveis pelas manifestações clínicas agudas e crônicas e levam a um estado contínuo de disfunção endotelial, deficiência funcional de óxido nítrico, estado oxidativo persistente, estéril estéril sistêmica, hipercoagulabilidade, aumento da adesão de neutrófilos e ativação plaquetária (12). Devido à prevalência estimada de DF e à ocorrência de epidemias regulares de dengue no Brasil, a infecção por dengue em pacientes com DF é um cenário desafiador devido ao risco potencialmente elevado de complicações sistêmicas associadas ao processo falciforme desencadeado pela infecção por dengue. Pacientes infectados pelo vírus da dengue e pacientes com DF compartilham a disfunção endotelial como principal mecanismo de ocorrência das manifestações clínicas. O aumento da permeabilidade vascular durante a infecção por dengue resulta da ativação de células endoteliais, e os possíveis mecanismos envolvidos são a infecção viral direta ou a liberação de múltiplas citocinas pelas células imunológicas infectadas (13).
A interação desses fatores com a complexa fisiopatologia da infecção pelo vírus da dengue, com ênfase especial no dano/disfunção endotelial e na ativação plaquetária, pode predispor ao desenvolvimento de disfunção orgânica, conforme observado nos dois casos relatados. No entanto, não se conhecem os motivos do não aumento das internações de pacientes com DF com complicações hepatobiliares graves e agudas (e outras crises falciformes agudas graves) desencadeadas pela dengue. Os achados descritos aqui não foram relatados anteriormente após uma extensa revisão da literatura.
Em conclusão, complicações graves e agudas da anemia falciforme podem ser desencadeadas pela infecção pelo vírus da dengue. É importante enfatizar que os médicos de linha de frente das unidades de emergência sabem reconhecer precocemente complicações incomuns e potencialmente fatais em pacientes com DF e complicações que podem ser desencadeadas pela infecção por dengue.
Agradecimentos
Os autores agradecem aos médicos do Serviço de Infectologia e da Unidade de Terapia Intensiva Adulto do Hospital de Clínicas da Universidade Federal do Triângulo Mineiro pela assistência prestada no atendimento aos pacientes aqui relatados.
Contribuição dos autores
LRO: concepção e desenho do estudo, aquisição de dados, análise e interpretação dos dados, redação do artigo, aprovação final da versão a ser submetida. ALCC: aquisição de dados, análise e interpretação dos dados, aprovação final da versão a ser submetida; PVA: aquisição dos dados, análise e interpretação dos dados, aprovação final da versão a ser submetida; LBRZ: análise e interpretação dos dados, aprovação final da versão a ser submetida; VAS: análise e interpretação dos dados, aprovação final da versão a ser submetida; SSS: análise e interpretação dos dados, aprovação final da versão a ser submetida.
Conflito de Interesses
Os autores declaram que não há conflito de interesses.
Apoio Financeiro
Nenhum.
ORCID
Leonardo Rodrigues de Oliveira: 0000-0003-1882-1694
Ana Laura Castro Costa: 0000-0003-0344-2632
Paula Veloso Almeida: 0000-0002-9973-2601
Luzia Beatriz Ribeiro Zago: 0000-0001-5184-3380
Vanessa Afonso da Silva: 0000-0003-0285-1178
Sheila Soares-Silva: 0000-0002-9474-1381
Referências
- Shah R, Taborda C, Chawla S. Acute and chronic hepatobiliary manifestations of sickle cell disease: A review. World J Gastrointest Pathophysiol. 2017;8(3):108-16. doi: 10.4291/wjgp.v8.i3.108.
- Martí-Carvajal AJ, Martí-Amarista CE. Interventions for treating intrahepatic cholestasis in people with sickle cell disease. Cochrane Database Syst Rev. 2017;7:CD010985. doi.org/10.1002/14651858.CD010985.pub3
- Im DD, Essien U, DePasse JW, Chiappa V. Acute on chronic liver failure in a patient with sickle cell anaemia (HbSS). BMJ Case Rep. 2015;2015. pii: bcr2015210166. doi: 10.1136/bcr-2015-210166.
- Ministério da Saúde (MS). Secretaria de Vigilância em Saúde. Departamento de Vigilância das Doenças Transmissíveis – Dengue: diagnóstico e manejo clínico, adulto e criança – 5ª edição. Brasília: MS; 2016. 60 p.
- Malik A, Merchant C, Rao M, Fiore RP. Rare but Lethal Hepatopathy-Sickle Cell Intrahepatic Cholestasis and Management Strategies. Am J Case Rep. 2015;16:840-3. doi: 10.12659/ajcr.895218.
- Guimarães JA, Silva LCS. Sickle cell intrahepatic cholestasis unresponsive to exchange blood transfusion: a case report. Rev Bras Hematol Hemoter. 2017;39(2):163-6. doi: 10.1016/j.bjhh.2017.02.006.
- Brunetta DM, Silva-Pinto AC, Macedo MCF, Bassi SC, Feliciano JVP, Ribeiro FB, et al. Intrahepatic Cholestasis in Sickle Cell Disease: A Case Report. Anemia. 2011;2011:975731. doi: 10.1155/2011/975731.
- Banerjee S, Owen C, Chopra S. Sickle cell hepatopathy. 2001;33(5):1021-8. doi: 10.1053/jhep.2001.24114.
- Khan MA, Kerner JA. Reversal of hepatic and renal failure from sickle cell intrahepatic cholestasis. Dig Dis Sci. 2011;56(6):1634-6. doi: 10.1007/s10620-011-1574-5.
- Ministério da Saúde (MS). Secretaria de Atenção à Saúde. Secretária de Ciência, Tecnologia e Insumos Estratégicos – Portaria Conjunta nº 05, de 19 de fevereiro de 2018. 1ª edição. Brasília: MS; 2018. 26 p.
- Ministério da Saúde (MS). Secretaria de Vigilância em Saúde. Boletim Epidemiológico 13: Monitoramento dos casos de arboviroses urbanas transmitidas pelo Aedes (dengue, chikungunya e Zika) até a Semana Epidemiológica 12 de 2019 e Levantamento Rápido de Índices para Aedes aegypti (LIRAa). Vol. 50. Brasília: MS; 2019. 18 p.
- Piel FB, Steinberg MH, Rees DC. Sickle Cell Disease. N Engl J Med. 2017;376(16):1561-73. doi: 10.1056/NEJMra1510865.
- Vervaeke P, Vermeire K, Liekens S. Endothelial dysfunction in dengue virus pathology. Rev Med Virol. 2015;25(1):50-67. doi: 10.1002/rmv.1818.
TABELA 1: Dados laboratoriais relevantes
| Laboratorial Parameter
(normal range) |
Case 1 | Case 2 | ||
| Admission | Day 2 | Admission | Day 3 | |
| Hemoglobin concentration
(12-16 g/dL) |
7.8 | 6.0 | 7.6 | 5.5 |
| Leukocyte count
(4-12 × 109/L) |
27.6 × 109/L | – | 12.2 × 109/L | 9.8 × 109/L |
| Neutrophils (%) | 83% | – | 76% | 79% |
| Lymphocytes (%) | 6% | – | 10% | 14% |
| Platelet count
(150-450 × 109/L) |
24 × 109/L | – | 714 × 109/L | 185 × 109/L |
| Reticulocyte count
(25-100 × 109/L) |
12 × 109/L | – | 93.7 × 109/L | 7.6 × 109/L |
| Conjugated bilirubin
(< 0.4 mg/dL) |
2.4 | 2.1 | 1.0 | 3.4 |
| Unconjugated bilirubin
(< 0.8 mg/dL) |
0.9 | 1.1 | 0.54 | 1.7 |
| Aspartate aminotransferase
(< 40 U/L) |
10,423 | – | 26 | 2,625 |
| Alanine aminotransferase
(< 33 U/L) |
5,895 | – | 21 | 1,807 |
| Serum lactate dehydrogenase
(135-225 U/L) |
5,925 | 8,823 | 272 | 2,493 |
| Serum creatinine
(< 1 mg/dL) |
1.34 | 2.2 | 0.67 | – |
| Blood urea nitrogen
(< 50 mg/dL) |
42 | 75.7 | 40 | – |
| Activated partial thromboplastin time
(25-34 sec.) |
40.5 s | 44.9 s | – | 77 s |
| Prothrombin activity
(70-100%) |
26.1% | 21.7% | – | 41% |
**Esta reportagem reflete exclusivamente a opinião do entrevistado.**